来自瑞士伯尔尼大学医院肺科的 Scherte 博士等介绍了一例体位相关性夜间呼吸困难患者的诊疗经过及其诊断思路。文章发表在近期的 CHEST 杂志上。
病例介绍
患者为男性,58 岁。因夜间发作的体位相关性呼吸困难和右侧卧位时的频繁觉醒,而被转诊至本文作者所在的睡眠诊所。患者自觉白天无呼吸道症状恶化,但感到疲劳,且醒后精力不能恢复。其 Epworth 嗜睡量表评分为 12/24。
患者既往有稳定性冠状动脉疾病、中度慢性肾衰竭,以及特发性肺纤维化(IPF)病史。2 年前曾接受右侧单肺移植,且在术后接受免疫抑制剂依维莫司、霉酚酸酯治疗。治疗期间恢复良好。
查体显示,体温正常,血流动力学稳定(血压 110/60 mm Hg;心率 71 次/分)、吸入室内空气时,由脉搏血氧仪测定的血氧饱和度(SpO2)为 95%,身体质量指数为 22.9 kg/m2。颈、喉部解剖正常。Mallampati 评分为 2 分。肺部听诊显示左肺有 Velcro 罗音,右肺呼吸音正常。脚踝周围有不连续的凹陷性水肿。肝-颈静脉回流征阴性。
辅助检查
患者转诊前的辅助检查已排除急性移植物排斥或感染可能;其肺功能检查结果稳定(移植后最佳 FEV1 为 1.89 L;74%);炎症标志物也在正常范围之内。
CT 扫描显示右肺实质正常,左肺表现为原已存在的完全毁损性 IPF,并伴有不连续的胸腔积液(图 1)。通气灌注显像显示有利于移植肺的通气和灌注分布,无血栓栓塞性疾病征象(图 2)。
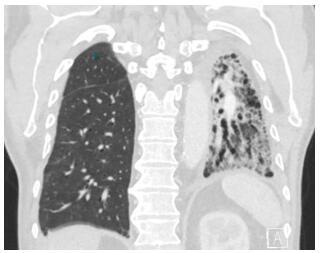
图 1 胸部 CT 扫描图像,显示左肺的特发性肺纤维化和右侧的移植肺。
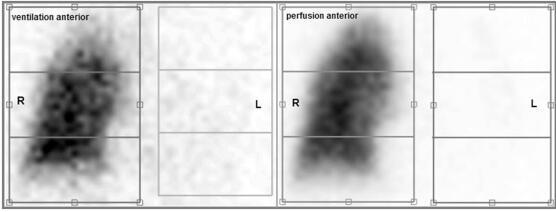
图 2 仰卧位通气灌注扫描图像,显示有利于移植肺的通气和灌注分布:灌注(左/右),5%/95%;通气(左/右),12%/88%。
超声心动图显示左室射血分数(LV-EF)为 50%,左心室弥漫性运动功能减退;右心室轻度扩张并伴有中度功能下降。右心室和右心房之间的压力梯度为 39 mm Hg,提示肺动脉高压。无心内分流存在。
整夜视频多导睡眠图(PSG)证实,当患者呈右侧卧位,也就是移植肺处于重力依赖位置时出现的呼吸困难,会导致其一夜之间多次觉醒,并伴有严重的低碳酸性睡眠呼吸障碍(图 3、图 4、视频 1)。图 5 显示了患者呼吸事件的体位依赖性。脑部 MRI 扫描未见异常。
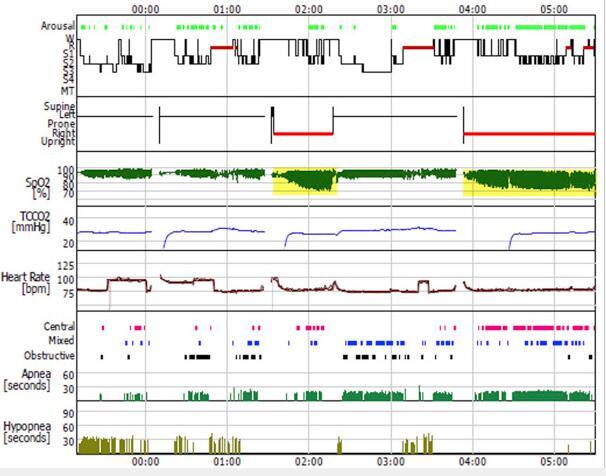
图 3 多导睡眠图概观。显示在右侧卧位时(体位图中红线区域)有明显的氧减饱和度(黄色背景)。MT = 运动时间;R = REM 阶段;S1-S4 = 1-4 期;TCCO2(PtcCO2)= 经皮二氧化碳压力;W = 觉醒。
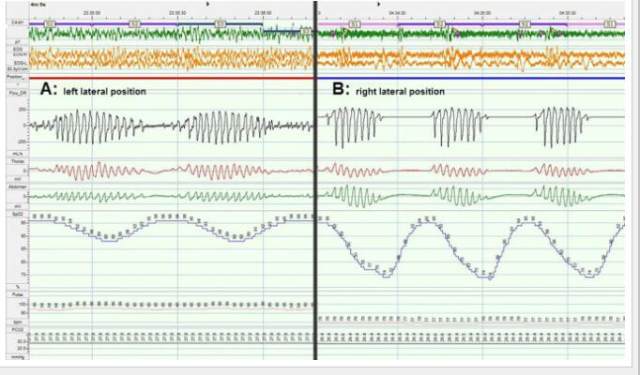
图 4 多导睡眠图记录的一段 5 分钟窗口。A,左侧卧位:中枢性睡眠呼吸暂停/潮式呼吸导致中度氧减饱和度。B,右侧卧位:伴有中枢性呼吸暂停后更大程度氧减饱和度的中枢性睡眠呼吸暂停/潮式呼吸。周期长度:左侧卧位,47.5 秒;右侧卧位,34.7 秒。EOG-L, EOG-R,分别代表眼动电图描记时的左、右眼电极;Flow_DR = 鼻呼吸流量。
TST | 仰卧位 | 非仰卧位 | 右侧下位 | 左侧下位 | |
时间,分钟 | 456.6 | 6.6 | 450.0 | 287.1 | 162.9 |
AHI,事件/小时 | 61.0 | 9.4 | 61.7 | 78.0 | 33.1 |
ODI,事件/小时 | 63.7 | 18.7 | 64.4 | 80.5 | 36.1 |
平均血氧饱和度,% | 88.1 | 91.6 | 88.1 | 85.7 | 92.2 |
最低血氧饱和度,% | 70.0 | 74.0 | 70.0 | 70.0 | 84.0 |
每个事件的平均减饱和度,% | 14.8 | 3.5 | 14.8 | 17.3 | 5.2 |
平均 Ptcco2, kPa | 3.7 | 3.4 | 3.6 | 3.3 | 3.9 |
平均周期长度,秒 | 42.2 | 无 CSR | 41.1 | 34.7 | 47.5 |
图 5 对多导睡眠呼吸事件的细分图,显示右侧卧位时氧饱和度恶化,并同时伴有明显的低碳酸血症。
AHI = 睡眠呼吸暂停-低通气指数;CSR = 潮式呼吸;ODI = 氧减饱和度指数;TST = 总睡眠时间。
根据上述临床表现,该患者被诊断为:低碳酸性中枢睡眠呼吸暂停,合并体位加重性通气-灌注不匹配。
讨论
本例低碳酸性中枢睡眠呼吸暂停(CSA)的诊断依据是:
多导睡眠图显示了伴有气流停止的周期性呼吸,以及在低 PaCO2情况下无呼吸努力的典型表现。此外,PSG 也显示其 CSA 有明显的体位相关性恶化;且患者在右侧卧位,也就是移植肺处于重力依赖位置时,会出现更大程度的低氧血症。
慢性过度换气和 PtcCO2 接近呼吸暂停阈值所致的通气不稳定可导致低碳酸性 CSA 的发生。后者也常见于心力衰竭和神经系统疾病患者、终末期肾功能衰竭患者、应用某些药物者,以及高海拔地区的旅行者。
此外,有小型队列研究显示,CSA 似乎在肺移植和 IPF 患者中更常见。该例肺移植患者同时患有 IPF、心力衰竭和肾脏疾病,虽然其 LV-EF 尚可,但已处于液体潴留状态。结合其单肺移植手术相关的特殊解剖情况、残留的 IPF 肺、重力和睡眠相关的肌肉张力变化等因素,最终导致了其通气、灌注和通气控制方面随后的体位相关性病理生理改变。
当体位从仰卧位改为侧位时,由于重力作用,健康人重力依赖肺的灌注增加约占心输出量的 10%~15%。在单肺移植受者中,其灌注常常立即出现有利于移植肺的改变,而后,随着时间推移,还会出现原生肺灌注的进一步逐渐下降。
本例患者左侧的 IPF 肺仅有轻微灌注,且在仰卧位扫描中的通气/灌注比(V/Q)仅为 5%(图 2)。在右侧卧位时,由于 IPF 肺为非重力依赖侧,所以其血流量甚至可能进一步恶化。
而同时发生的通气变化,则与之相反:由于睡眠相关的肌张力减少,以及纵隔和腹部器官的机械压迫作用,处于重力依赖侧的肺,将出现顺应性改变和功能残气量(FRC)减少。为了弥补这一点,健康人非重力依赖肺的通气将优先增加,并出现上肺 FRC 增加;而低氧性血管收缩将会减少重力依赖肺通气较少部分的血流。
通过这种方法,通常可以维持健康人正常的氧合。但当本例单肺移植受者处于右侧卧位时,其严重受损,且几乎无灌注 IPF 肺的通气改善,将主要导致死腔通气量增加,而对氧合的改善作用很有限。因此,随着灌注仍然很好的移植肺的通气受损,即使在处于重力依赖侧,且通气不佳移植肺区发生代偿性低氧血症性血管收缩的情况下,患者的 V/Q 失配仍会增加。
此外,在这种液体负荷过重的患者中,夜间从脚到胸的喙侧液体转移可能会导致其肺毛细血管楔压升高、胸腔内液体含量增加,以及肺组织的细胞外积水。在侧卧位时,这些额外液体也将因重力作用转移至重力依赖肺。而移植肺因手术导致淋巴管被切断、淋巴引流和循环机制受损,其发生肺水肿的风险也会更大。
因此,除了 V/Q 失配增加和通气反应的变化,这种肺充血改变,也可能进一步恶化患者的氧合。此外,在右侧卧位时明显的低氧血症,也会通过低氧血症性通气反应(包括过度换气和低碳酸血症)而促进 CSA 发生。这在多导睡眠图上主要表现为更大程度的低氧血症、较低的 PtcCO2,和较短的周期时间(图 3, 4)。
而化学感受器敏感性的变化,也可能促成该患者在不同侧卧位时的通气不稳定。
由于缺少超声心动图或其他血流动力学方面的辅助检查,目前只能推测,移植相关的胸腔解剖变化和萎缩的 IPF 肺,会增强体位改变对于患者心腔大小、心脏充盈、心输出量,及其血流动力学,特别是循环时间的影响。
尽管病理生理学复杂,但该患者的治疗选择仍主要集中于潜在心、肾衰竭的药物治疗和优化液体管理方面。为缓解其夜间呼吸困难,可尝试体位调节策略和气道正压通气治疗。
临床经过
该患者接受了心力衰竭治疗药物优化和白天加压袜装治疗。由于肩部疼痛,不能耐受长时间的左侧卧位,患者已开始伺服通气( Adaptive Servo-Ventilation, ASV)治疗,且 LV-EF 得到较好保持。此后,其 CSA 和夜间症状都得到良好控制。
下载的 ASV 设备数据显示,其睡眠呼吸暂停得到有效治疗:平均每晚使用 7.5 小时;在接受呼气末正压 4 cm H2O 和 3~10 cm H2O 压力变动的 ASV 治疗期间,残余呼吸暂停-低通气指数平均为 0.1/h。在所有体位下,使用 ASV 时的血氧饱和度都>90%。
关键点
1. 肺移植术后的夜间症状评估应包括多导睡眠图;
2. 呼吸力学和灌注的改变可能有助于解释单肺移植后低氧血症和通气控制稳定性的体位性变化;
3. 虽然这种单肺移植受者的病理生理很复杂,但中枢性睡眠呼吸暂停的常规治疗方法,仍能有效缓解其症状。
