11 月 29 日,国家食品药品监督管理局(CFDA)发布了《关于修订注射用脂溶性维生素(Ⅰ)等 5 个品种说明书的公告(2017 年第 140 号)》。
注射用脂溶性维生素(Ⅰ)
注射用脂溶性维生素(Ⅱ)
脂溶性维生素注射液(Ⅰ)
脂溶性维生素注射液(Ⅱ)
复方维生素注射液(4)
总局决定对上述 5 种复方脂溶性维生素说明书【不良反应】、【禁忌】、【注意事项】等项进行修订。

具体修订要求如下:
复方脂溶性维生素注射剂产品包括注射用脂溶性维生素(Ⅰ)、注射用脂溶性维生素(Ⅱ)、脂溶性维生素注射液(Ⅰ)、脂溶性维生素注射液(Ⅱ)、复方维生素注射液(4)。以上产品说明书须按下列要求修改:
1. 【不良反应】增加以下内容:
上市后监测到的不良反应/事件为:
全身性损害:寒战,发热,胸痛,乏力。
皮肤及其附件损害:皮疹,瘙痒,出汗,荨麻疹,斑丘疹。
胃肠损害:恶心,呕吐,腹痛,消化不良。
呼吸系统损害: 呼吸困难,呼吸急促,咳嗽。
心血管系统损害:心悸,心律失常,紫绀,血压升高。
免疫功能紊乱和感染:过敏性休克,过敏反应。
神经系统损害: 头晕,头痛,眩晕。
血管损害和出凝血障碍: 潮红,静脉炎。
用药部位损害: 注射部位疼痛。
视觉损害:视物模糊,复视。
肝胆损害:血清氨基转移酶升高,碱性磷酸酶升高,胆红素升高。
2. 【禁忌】增加以下内容:
(1)对本品任一成分过敏者禁用。
(2)维生素过多症者禁用。
3. 【注意事项】增加以下内容:
(1)过敏体质者及肝、肾功能异常者慎用。
(2)注意可能发生的严重过敏反应,使用时应加强监护。使用中出现呼吸困难、呼吸急促、胸闷、心慌、心率加快等,应立即停用,并采取相应的治疗措施。
(3)对于长期接受胃肠外多种维生素作为体内维生素主要来源的患者,应定期监测维生素的浓度,以确定维生素缺乏或过量。
(4)本品长期大量使用应注意产生脂溶性维生素过多综合征。
(注:说明书其他内容如与上述修订要求不一致的,应当一并进行修订。)
公告中明确要求:
1. 所有复方脂溶性维生素注射剂生产企业均应依据《药品注册管理办法》等有关规定,按照复方脂溶性维生素注射剂说明书修订要求(见附件),提出修订说明书的补充申请,于 2018 年 1 月 31 日前报省级食品药品监管部门备案。
修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。在补充申请备案后 6 个月内对所有已出厂的药品说明书及标签予以更换。
各复方脂溶性维生素注射剂生产企业应当对新增不良反应发生机制开展深入研究,采取有效措施做好使用和安全性问题的宣传培训,指导医师合理用药。
2. 临床医师应当仔细阅读复方脂溶性维生素注射剂说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的效益/风险分析。
3. 患者应严格遵医嘱用药,用药前应当仔细阅读说明书。
众所周知,对于因疾病、手术创伤等原因不能进食或严重营养不良的患者,常常要用到肠外营养进行能量补充。
脂溶性维生素包括维生素 A、维生素 D、维生素 E、维生素 K,通常以复方制剂形式应用于临床,常用的主要有注射用脂溶性维生素(I)、脂溶性维生素注射液(I)、注射用脂溶性维生素(II)、脂溶性维生素注射液(II)、复方脂溶性维生素(4)
(注:通常药品名称为「注射用XXX」是指该制剂为粉针剂或冻干粉针剂,属于固体制剂,使用时需要先溶解;而「XXX注射液」是指该制剂为液体制剂,后同。)
脂溶性维生素不良反应屡见报道
在此次修订之前,各类脂溶性维生素的说明书中关于【不良反应】的表述都极其有限:
偶见体温上升和寒战;
经 4~6 周输注后,可能出现血清氨基转移酶、碱性磷酸酶和胆红素升高,减量或停药即可恢复正常;
对本品中任何一种成分过敏的患者对本品均可能发生过敏反应。
部分品种的【不良反应】一栏甚至为「尚不明确」,「未进行该项实验且无可靠参考文献」。
早在 2008 年,国内就有静滴复方维生素注射液(4)致过敏性休克的病例报告 [6] ,此后相关报道和研究逐渐增加。
中国期刊全文数据库(CNKI)检索结果显示,2008 年至今,关于脂溶性维生素不良反应的文献达 41 篇,涉及不良反应病例 203 例,其中脂溶性维生素(I)制剂 57 例,脂溶性维生素(II)制剂 142 例,复方脂溶性维生素(4)制剂 4 例,严重不良反应占 60% 以上。
不良反应的类型主要为不同程度的过敏反应,发病时间多在用药后 30 min 以内(约占 80%),最快者用药 1min 即出现不适症状,最迟者可在用药 6 d 后方出现迟发性超敏反应。
减少不良反应需从多方面入手
药物不良反应的发生受到多方面因素的影响,包括:药物组分(包括主要成分和辅料)、超适应证用药、超剂量使用、药物浓度偏大、给药速度过快、配伍不当等。
1. 有效成分相同,但含量不一
目前临床上应用的复方脂溶性维生素制剂的有效组分相同,均为维生素 A,维生素 D 2 ,维生素 E,维生素 K 1 。但含量不同;甚至同一种制剂,由于厂家差异,其主要成分的含量和辅料种类也不尽相同。 如表 1 所示:
表 1 不同脂溶性维生素制剂的主要成分
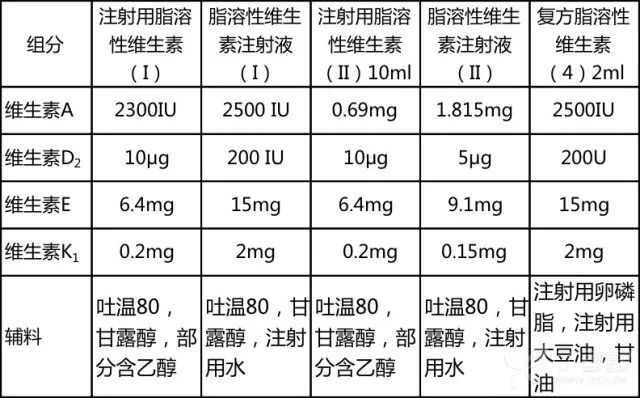 注:以上所列含量为单位制剂含量,由于厂家不同,含量可能存在差异,以实际说明书为准。
注:以上所列含量为单位制剂含量,由于厂家不同,含量可能存在差异,以实际说明书为准。
由于脂溶性维生素为复方制剂,因而对其中任何一种成分过敏的患者均可能发生过敏反应。
在 4 种主要成分中,以维生素 K 1 的不良反应发生率最高。维生素 K 1 具有半抗原性,可与血液中蛋白质结合成抗原而具有免疫原性,引发过敏反应(参见: 维生素 K 1 不简单,这 4 大问题要搞清 )。
药物辅料多为乙醇、吐温 80、吐温 20、甘露醇等。对乙醇过敏者应谨慎使用,与部分头孢菌素等药物合用时还需警惕双硫仑样反应;吐温 80 可引起 RBL-2H3 细胞脱颗粒释放炎性介质如组胺、β-氨基己糖苷酶等,从而产生一系列的病理生理反应,其急性超敏反应发生率为 5%~40%。
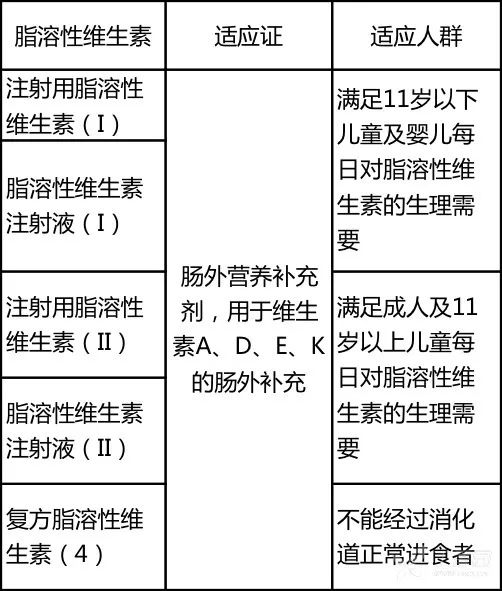
2. 适应证相同,但适应人群不同
脂溶性维生素主要作为不能经消化道正常进食患者的肠外营养补充剂,用于满足人体每日对脂溶性维生素 A、维生素 D 2 、 维生素 E、维生素 K 1 的生理需要。
需要强调的是,脂溶性维生素在体内有一定的储备,短期禁食者不至于缺乏,全肠外营养 4 周以上才予以补充。
此外,虽然各个品类的脂溶性维生素适应证基本相同,但适用人群却存在差异,需区别选用(见表 2)。
表 2 不同脂溶性维生素制剂的适应人群
3. 规范给药方式,避免不良反应
(1)溶媒选择:各类脂溶性维生素的说明书均要求用生理盐水或 5% 葡萄糖溶液作为溶媒。也有研究认为,脂溶性维生素在脂肪乳中的溶解度更高,采用脂肪乳作为溶媒可减少用药过程中的不良反应。
(2)给药浓度和速度:药物浓度过高、静脉输注速度过快,也会增加不良反应的发生率。尤其对于老年人或身体虚弱者,用药时应保持较低的血药浓度。
彭欣 [9] 对 26 例脂溶性维生素注射液出现不良反应的患者的临床资料进行回顾性分析后发现,10 mL 脂溶性维生素溶于 500 mL 溶媒中静脉滴注,不良反应发生率最低。滴速控制在 20~40 滴/分,500 mL 溶液注意控制滴速在 3 h 以上。
(3)谨慎配伍:将多种药物混在一起,其热原量会累加,可能超过人体耐受量,从而使一些耐受力较差的患者出现输液反应,在临床使用时应尽量减少不必要的联用。
由于本品含有维生素 K 1 ,不宜与香豆素类抗凝血药物合用。
也有研究称,脂溶性维生素(II)与奥美拉唑钠 [3] 、低分子右旋糖酐 注射液 [4] 、 门冬氨酸鸟氨酸 [5] 存 在配伍禁忌。
4. 其他注意事项
所有的复方脂溶性维生素制剂均必须稀释后输注,不得直接使用。
所有制剂均要求在使用前 1h 配制,8h 内使用完。
由于维生素类制剂对光、热十分敏感,因此建议 2-10℃ 避光保存,避光输注。
首次使用复方脂溶性维生素要注意过敏的发生,使用过程中密切观察患者反应。
长期大量使用需要注意脂溶性维生素过多症。
首发 | 临床用药
编辑 | 孙紫烟 李晴 投稿 | liq@dxy.cn 图 | shutterstock
参考文献
1. 注射用脂溶性维生素(I)、脂溶性维生素注射液(II)、复方脂溶性维生素注射液(4)药品说明书
2. 肠外肠内营养学临床指南系列——住院患者肠外营养支持的适应症,中华医学会肠外肠内营养学分会 中国危重病急救医学,2006,10(18):591-594
3. 李丽辉,奥美拉唑钠与脂溶性维生素注射液(II)存在配伍禁忌【J】,中国现代临床护理学杂志,2009.4(5)
4. 赖敏灵,脂溶性维生素II冻干粉与低分子右旋糖酐注射液存在配伍禁忌【J】,当代护士,2015(11)
5. 注射用门冬氨酸鸟氨酸与注射用脂溶性维生素(II)存在配伍禁忌【J】,中国健康月刊 B刊,2011,10(10)
6.王争鸣,赵乾,静滴复方维生素注射液(4)致过敏性休克 3 例,浙江临床医学 , 2008 , 10 (9) :1244-1244
7. 张勇等,注射用脂溶性维生素的不良反应文献分析及药学监护,中国药房,2014,25(46):4393-4395
8. 孙朋波,刘慧慧,王慧玲,注射用脂溶性维生素 II 不良反应观察分析及处理,临床与转化医学,2015,2(5):134-135
9. 易丹,44 例注射用脂溶性维生素不良反应文献分析,中国药物警戒,2015,12(3):172-181
10. 彭欣,脂溶性维生素注射液 II 不良反应观察及护理要点,护理与临床,2011,15(12):1115-1116
