英国伦敦 Royal Brompton 医院 Anand Shah 医生等详细报道了一例塑型性支气管炎的诊疗经过。文章发表在近期出版的 Chest 上。现在让我们跟着作者一起来参与这例罕见的塑型性支气管炎的诊断和治疗。
病史介绍
患者,男性,74 岁,因咳支气管管型样痰(图 1)伴呼吸衰竭,从当地医院转诊至 Royal Brompton 医院接受进一步治疗。
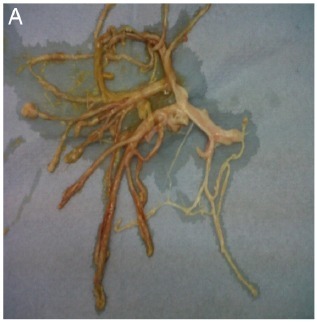
图 1 患者咳出的支气管管型样痰。
患者从青少年时期开始就有反复肺部感染伴偶发咯血。至当地医院就诊,除外了哮喘、结核(TB)或百日咳等肺部疾病可能。给予使用抗菌药物治疗,但患者间歇性慢性反复咳支气管管型样痰症状无好转。
患者 41 岁时,接受了纤维支气管镜检查。支气管镜下发现:右中叶支气管粘膜红斑。行肺通气/灌注扫描发现:右肺通气功能下降。支气管灌洗液细菌学检查阴性。当时接诊医生考虑病变在右中叶,故行右中叶切除术。术后病理报告示:右中叶支气管周围有非特异性炎性纤维化。
但是患者的肺部症状在手术后并无好转。对支气管管型样痰行细菌学检查,结果为阴性;行组织学检查示:含有淋巴细胞、纤维蛋白及粘液蛋白。行免疫功能和过敏相关检查均正常。
给予试验性激素治疗、雾化吸入乙酰半胱氨酸和高渗盐水、预防性阿奇霉素使用、全身抗真菌药物治疗和口服环磷酰胺,但患者症状无明显好转。
患者肺部症状保持相对稳定。但是从 73 岁起,患者咳支气管管型样痰和肺部感染变得越来越频繁。近期,患者因肺部症状加重、呼吸衰竭收治入当地医院治疗;后转诊入 Royal Brompton 医院接受进一步诊断和治疗。
抽丝剥茧,揭开咳痰真相!
入院时,患者呼吸窘迫。吸入氧浓度(FiO2)为 60% 的情况下,氧饱和度为 90%。行动脉血气分析显示:pO2 6.72kPa,pCO2 6.31kPa,pH 7.38,碳酸氢根 30.5 mmol/L。行胸片示:右肺实变影。血液学检查示:白细胞计数正常,C 反应蛋白(CRP)为 10 mg/L。
给予经验性使用静脉特治星、卡泊芬静、氢化可的松抗感染,晶体补液,雾化吸入支气管扩张剂,同时转入加护病房。
追问病史,患者既往有缺血性心脏病病史,接受了左前和左后降支动脉支架治疗。患者既往吸烟,5 包年,目前已戒烟。患者与家人生活在一起,无特殊的环境暴露因素。既往无鼻窦炎病史,查体未发现黄色指甲。
行肺功能检查示:用力呼气量(FEV1)为 1.05L/s,用力肺活量(FVC)为 2.37L,FEV1/FVC 为 0.44。
行肺部 CT 示:弥漫性支气管壁增厚伴双侧轻度斑片状磨玻璃影。右上肺弥漫性实变影。两下肺小叶间隔轻度增厚(图 B 和 C)。
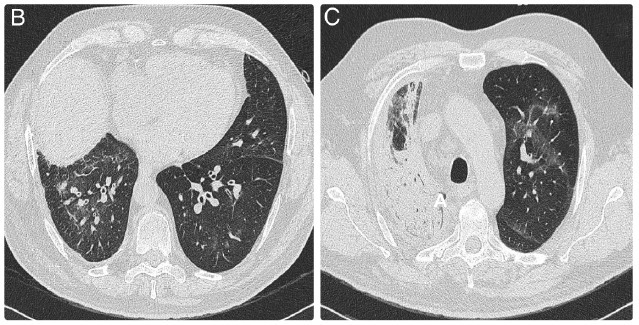
图 2:肺部CT示,弥漫性支气管壁增厚伴双侧轻度斑片状磨玻璃影。右上肺弥漫性实变影。两下肺小叶间隔轻度增厚。
结合患者病史及临床特点,临床医生诊断为塑型性支气管炎。塑型性支气管炎是一种罕见的临床疾病,其临床特点为:此类患者会产生致密凝胶状粘液并造成支气管阻塞。
根据塑型性支气管炎的组织学特点,可将其分为两型:I 型为炎症型(气道内粘液中含有大量纤维蛋白、嗜酸性粒细胞和夏科-雷登晶体),II 型为非炎症型(气道内粘液主要为非细胞成分,包括粘液蛋白和少量纤维蛋白)。
目前尚不清楚塑型性支气管炎的确切病因。已知最常见的病因为淋巴管畸形(导致乳糜样痰的产生)。其他可能的病因包括:紫绀型先天性心脏病、囊性纤维化和镰状细胞病。
具体到这名患者,目前尚不清楚导致其塑型性支气管炎的病因及组织学分型。可惜的是,现已无法获得患者右中叶切除术时的手术标本,无法使用新的淋巴标志物染色技术(如:D2-40,LYVE-1)来诊断。临床医生转而考虑通过评估患者现有气道分泌物来明确诊断。
支气管管型样痰组织学检查示:主要为非细胞成分,含有粘液蛋白和纤维蛋白。微生物学检查为阴性。分泌物液化后离心示:一个浑浊的脂肪分层溶液。生化分析显示:乳糜液,甘油三酯 32.5 mmol/L(图 D)。
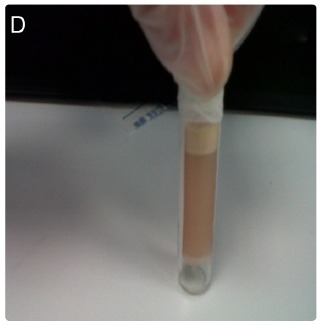
图 3:分泌物液化后离心示,一个浑浊的脂肪分层溶液,为乳糜液。
支气管管型样痰,如何治疗?
临床医生给予这名患者使用低脂中链甘油三酯饮食,同时联用奥曲肽治疗。奥曲肽是生长抑素类似物。有研究指出:奥曲肽可使包括肝静脉在内的内脏血管轻度收缩,这会使得胃、胰腺和肠道分泌和吸收减少,乳糜形成也相应减少。
但是对于存在明显支气管管型样痰的患者,在上述治疗的基础上,仍需去除(取出或液化)支气管内异物。
查阅文献后发现,单纯使用支气管镜移除上述支气管内分泌物是非常困难的。这些气道分泌物非常致密,很难通过吸引去除;而钳夹又容易断裂破碎。可考虑在支气管镜的技术上联用新技术(如:冷冻疗法)加以去除。
患者接受了支气管镜检查,但未发现支气管管型样分泌物,仅看到水肿塌陷的右下叶和右上叶支气管。因此,患者未能通过支气管镜接受任何治疗。支气管灌洗液微生物学检查结果为阴性。支气管镜活检仅提示为非特异性炎症。
临床医生转而考虑液化支气管内分泌物。有文献指出,雾化吸入脱氧核糖核酸酶-α(DNase)和组织型纤溶酶原激活剂(t-PA)可液化乳糜性支气管分泌物。鉴于患者植入药物洗脱冠状动脉支架后使用双重抗血小板治疗,临床医生首先通过体外试验评估了 DNase 和 t-PA 的疗效。
临床医生将患者咳出的支气管管型样痰(干燥的)分别培养于 2 mL 浓度为 0.1 mg/mL t-PA、浓度为 0.1 mg/mLDNAse 和生理盐水中。2 小时后,取出支气管管型样痰,风干后,重新称重;同时分析了上清液中蛋白质和纤维蛋白分解产物的浓度。
研究发现,t-PA 培养后,分泌物结构破坏,质量减少 62%,上清液中蛋白质浓度为 0.47 g/L,可溶性交联纤维蛋白(XDP)浓度>4×106ng/mL。DNase 培养后,分泌物结构无破坏,质量减少 10%,上清液中蛋白质浓度为 0.07 g/L,XDP 浓度为 40000ng/mL。生理盐水培养后,分泌物结构无破坏,质量减少 2%,上清液中蛋白质浓度为 0.0 g/L,XDP 浓度为 1200 g/mL。
上述结果说明,DNAse 可达到完全液化效果,t-PA 可达到部分液化效果。故在密切监护下,给予这名患者 DNAse(2.5 mg,一天两次)和 t-PA(5 mg,一天三次)治疗。24 小时内,患者影像学上即出现了显著改善,且无出血并发症出现。
但是,液化治疗后患者出现了分泌物清除困难、间歇性缺氧和新管型的形成,这造成了新发的支气管阻塞。临床医生决定对乳糜性支气管管型的病理生理学机制加以分析,据此制定新的治疗方案。
文献报道,II 型塑型性支气管炎与先天性心脏病有关,特别是 Fontan 手术后;有学者认为,升高的中心静脉压和肺静脉压可能在支气管管型的形成中发挥了一定的作用。
因此,给这名患者行心超检查。心超示:左心室收缩和舒张功能正常,左心室后下侧壁轻度运动功能减退。右心轻度扩张。无瓣膜异常。右心房大小正常,肺动脉收缩压约为 51 mmHg。基于此,给予患者西地那非扩张肺血管治疗,剂量逐渐增加至 50 mg,一天三次。
根据患者病程、辅助检查结果及童年起病的特点,临床医生考虑这名患者的病因诊断可能为广泛性淋巴管畸形(GLA)。
GLA 是一系列临床综合征,可发生在身体任何含有淋巴管的组织中,包括先天性、良性、局部淋巴管增生等。该疾病可导致限制性和/或阻塞性病变、乳糜型胸腔积液和呼吸衰竭,好发于儿童和青年人。
为了明确有无淋巴管阻塞,给予患者行淋巴管闪烁造影(图 E)显示:右肺存在活动异常,这证实了乳糜漏的存在。最近文献报道,磁共振淋巴管造影术显像更清楚,且可以通过该造影术行经皮胸部淋巴漏栓塞术(但是,在这名患者住院时,该技术尚未完善)。
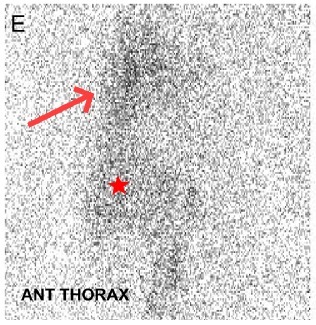
图 4 淋巴管闪烁造影显示:右肺存在示踪活动异常(红色箭头),这证实了乳糜漏的存在。
查阅文献后发现:使用雷帕霉素靶蛋白(mTOR)抑制剂西罗莫司(雷帕霉素),可治疗因淋巴管平滑肌瘤(PLAM)导致的复发性乳糜胸。
PLAM 是一种进行性肺囊肿性病变,好发于女性。PLAM 是因为 mTOR 信号通路异常激活导致的细胞生长失调和淋巴管增生。PLAM 会导致复发性乳糜胸和咳乳糜痰(罕见情况下)。
最近文献报道,使用西罗莫司可成功治疗 PLAM 导致的乳糜胸,稳定肺功能。具体作用机制尚不明确,但可能是由于西罗莫司可使异常平滑肌细胞增生减退相关(这种异常增生会导致淋巴系统阻塞和渗漏的发生)。
鉴于患者存在淋巴管阻塞且临床症状逐渐恶化加重,临床医生给予这名患者使用西罗莫司治疗,剂量逐渐加量至 5-10ng/mL。患者临床症状逐渐好转,后成功出院。
出院后随访肺功能显示:肺功能显著改善。CT 显示:右侧肺实变完全缓解。出院后 3 个月,患者不再咳出支气管管型样痰。患者维持低脂甘油三酯(MCT)饮食,继续使用西罗莫司和 DNase。2 年后,患者几乎不再咳出支气管管型样痰,生活质量和肺功能得到了显著的改善。未发现西罗莫司治疗相关副作用。
西罗莫司可有效治疗有淋巴管阻塞或乳糜漏的患者。西罗莫司是一种大环内酯类结构相关的钙调神经磷酸酶抑制剂 FK506,具有强效免疫抑制特性。西罗莫司可以和 mTOR 结合,并抑制 mTOR 活性(mTOR 是一种丝氨酸/苏氨酸激酶,由磷脂酰肌醇-3 激酶调节)。
这会抑制各种 G1 期细胞周期 mTOR 介导的信号传导通路。西罗莫司也可抑制白介素-2 诱导的 T 细胞增生,这使得西罗莫司具有免疫抑制作用,可用于实体器官移植中避免器官排异的发生。
最近的遗传学研究发现,淋巴管畸形患者的磷脂酰肌醇-3 激酶(PIK3CA)的催化亚单位存在体细胞突变,这会造成淋巴上皮细胞的过度增生。西罗莫司具有抗淋巴管增生效应,可改善此类患者转归。这一发现或许为先天性淋巴管阻塞患者提供了一个潜在的基因靶向治疗方向。
