患者,男,68 岁,身高 172 cm,体重 69 kg,BMI 23.3 kg/m2,血型 AB、Rh(+)。4 年前因间断咳嗽,于当地行胸部 CT 检查提示双肺近胸膜处呈网格状改变,考虑特发性肺纤维化(IPF),2 年来出现活动后呼吸困难,曾服用泼尼松龙,起始量 40 mg qd*70 天,后逐渐减量至停用,同时应用复方环磷酰胺 50 mg tid,患者症状无改善,2017-5-22 胸部 CT 示双肺病变较前明显加重(图 1),肺功能提示弥散功能 (DLCO SB) 进行性下降,33.8%→29.6%→23.2%→14.6%,未吸氧血气分析 PaO2 62.1 mmHg→52.6 mmHg→46.8 mmHg。超声心动图提示左室舒张功能减低,肺动脉高压(中度),估测 59 mmHg。既往吸烟 20 年,40-60 支/天,戒烟 4 年。
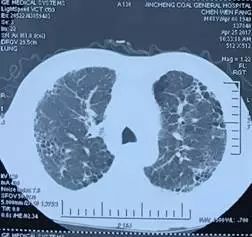
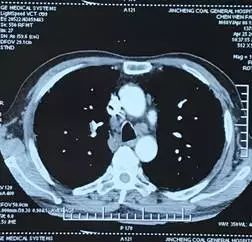

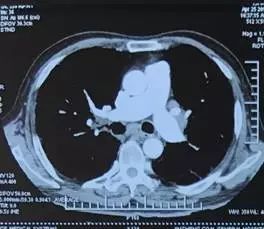
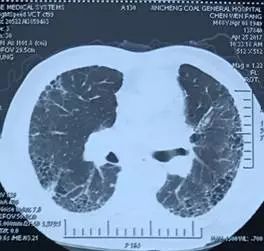
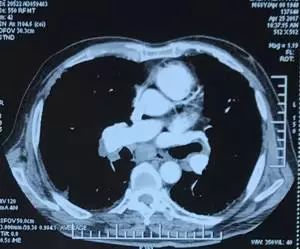
图 1
患者完善肺移植术前评估,于 2017 年 6 月 10 日行「右单肺移植术」,供体组织标本培养:耐甲氧西林的金黄色葡萄球菌(MRSA)、黑孢子菌属。受体右肺上、中、下叶组织培养均为阴性。
术后 9 天(6 月 19 日)复查胸部 CT(图 2):肺移植术后,右侧胸腔少量积液,纵隔内可见极少量气体影(经反复阅片发现)。
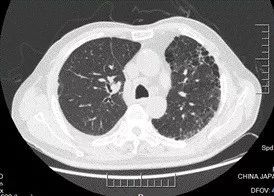
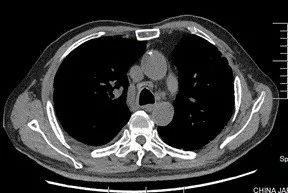
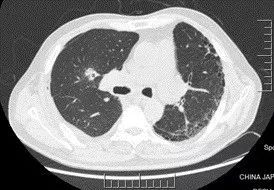
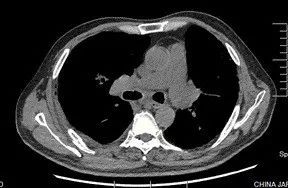
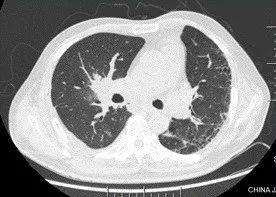
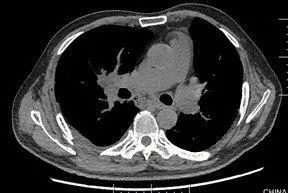
图 2
术后第 16 天 BALF 培养烟曲霉菌,BALF GM 6.64,血 GM 0.21。
术后第 20 天气管镜检查可见手术吻合口周围大量黄白色坏死物附着,内侧壁覆盖一层薄膜样坏死物,随呼吸摆动(图 3)。
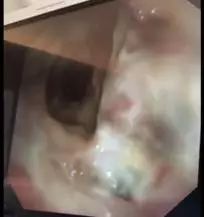
图 3
术后第 24 天(2017 年 7 月 4 日)复查 CTPA(图 4)示右主支气管与纵隔相通,形成纵隔气肿、空腔,右侧大量胸腔积液,肺动脉及各级分支未见血栓。行右侧胸腔穿刺闭式引流,引出大量暗红色血性液体,量约 1400 ml,考虑吻合口出血可能。患者自诉头晕、乏力,生命体征平稳,急查血常规,血色素 107 g/L 较前无明显下降,给予止血、补液、输血、血浆等治疗后出血停止。
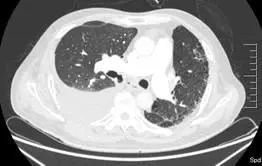
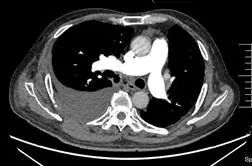
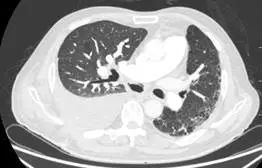
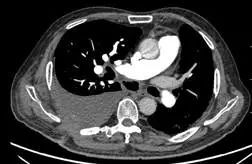
图 4
术后第 32 天复查气管镜(图 5)可见吻合口周围大量黄白色坏死物附着并瘘口形成,气体随呼吸进出瘘口。
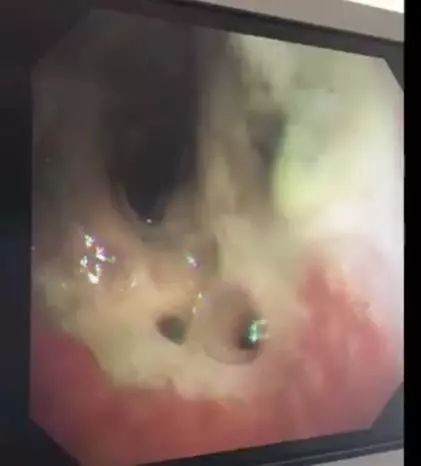
图 5
自此患者支气管吻合口瘘诊断明确,治疗策略:
1. 支气管吻合口瘘:患者因感染造成吻合口瘘,无手术修补指征,间断行支气管镜检查,清除气道内坏死物及粘稠分泌物。术后第 33 天复查胸部 CT(2017 年 7 月 13 日,图 6),示纵隔内空腔稳定,肺内未见明显浸润影。因患者气道、纵隔、右侧胸腔完全相通,给予持续右侧胸腔引流,每日引出淡黄色浑浊至清亮液体,量约 90~200 ml;
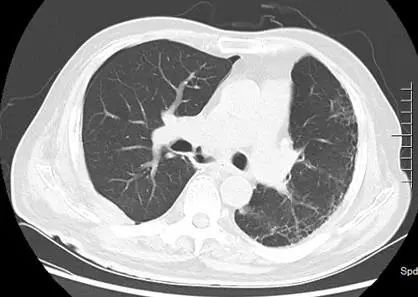
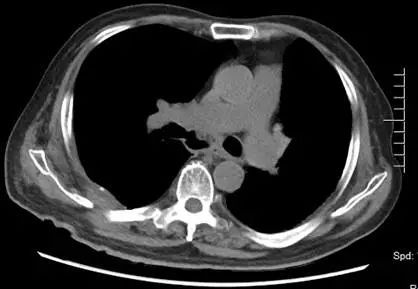
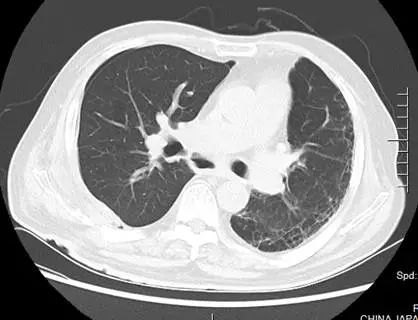
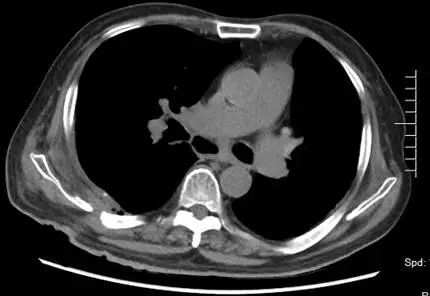
图 6
2. 感染(抗感染方案见图 7):(1)真菌感染:术后予卡泊芬净静点+两性霉素雾化预防真菌治疗,术后第 12 天因无真菌感染证据,停用卡泊芬净。术后第 16 天 BALF 培养烟曲霉菌,BALF GM 6.64,血 GM 0.21,给予伏立康唑静点,术后第 20 天发现吻合口瘘形成,考虑与气管支气管曲霉菌病、吻合口烟曲霉感染有关,在伏立康唑静点、两性霉素 B 雾化基础上再次加用卡泊芬净加强抗真菌治疗。动态监测血及 BALF GM 试验正常,术后第 52 天停用卡泊芬净,继续应用伏立康唑静点及两性霉素 B 雾化抗真菌治疗;(2)细菌:术后给予头孢吡肟联合万古霉素抗感染,术后第 9 天痰培养回报:碳青霉烯耐药的鲍曼不动杆菌(CRAB),停用头孢吡肟,根据药敏结果改为头孢哌酮/舒巴坦+替加环素抗感染;术后 1 月患者出现咳嗽、咳痰略有增加,血常规示 WBC 18.2×109/L,NE% 80.2%,痰培养为碳青霉烯耐药的铜绿假单胞菌(CRPA),将抗细菌药物改为哌拉西林他唑巴坦,复查血常规示白细胞降至正常,PCT、CRP、ESR 正常,故术后第 49 天停用抗细菌药物。患者多次 BALF 及胸水中培养出广泛耐药(XDR)的 CRPA 和 CRAB,监测感染指标正常,未再应用抗生素;(3)病毒:BALF 的 CMV-PCR 阳性,给予更昔洛韦治疗,监测血 CMV-PCR 阴性;(4)人肺孢子菌:予增效联磺预防肺孢子菌。(图 7 患者病原学结果及用药情况)
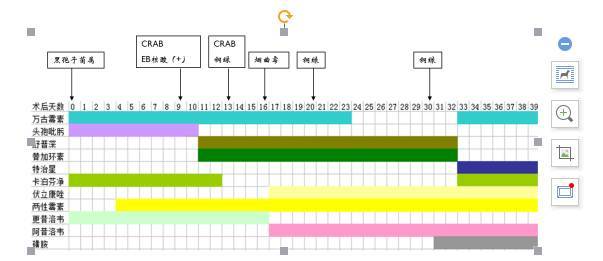
图 7:患者病原学结果及治疗经过
3. 排斥(排斥方案见图 8 及 9):术后给予甲泼尼龙+他克莫司+吗替麦考酚酯(MPA)抗排斥治疗,根据 FK506 浓度调整他克莫司用量。患者发生支气管曲霉菌感染、吻合口瘘后,下调 FK506 浓度、减量 MPA;
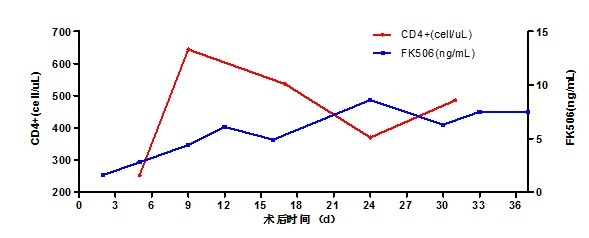
图 8:患者抗排异药物与淋巴细胞水平

图 9:患者免疫抑制剂使用情况
4. 营养支持:鼓励患者进食,保证能量供应,间断补充血浆、白蛋白加强营养支持,控制血糖,保持血糖平稳;
5. 康复锻炼:进行积极呼吸康复+肢体康复治疗;
6. 其他治疗: 患者间断出现双下肢水肿,给予利尿、补充电解质治疗;患者应用伏立康唑后出现肝功能异常,给予积极保肝治疗后好转;监测肾功能,根据肌酐清除率调整药物剂量。
患者最终于手术后 3 个月康复出院。
气管支气管曲霉病(Tracheobronchial Aspergillosis,TBA)是肺部曲霉感染的一种形式 [1]。2016 年美国感染病学会(IDSA)制定关于曲霉病治疗的指南中根据内镜下组织病理不同将 TBA 分为气道内定植、过敏(ABPA)和侵袭性 TBA,其中侵袭性 TBA 包括溃疡性支气管炎、假膜性气管支气管炎,二者可能是同一种疾病的两种表现形式,前者只是侵犯到了粘膜,在肺移植、AIDS 和骨髓移植病人中最常见到,镜下表现为气管粘膜表面不连续的溃疡或者地图样的粘膜损伤,而后者的侵犯深度则可到达软骨,在恶性血液病,或者造血干细胞移植后合并移植物抗宿主病的病人中较多见,镜下表现为气管支气管表面大片的膜状物的附着 [2]。
吻合口感染是肺移植术后曲霉感染不同于其他器官移植的特殊表现,吻合口通常在移植后的 1~6 个月内发生感染,且大部分在 3 个月内,这可能和肺移植后早期严重的免疫抑制、吻合口的缺血、气道防御反射、粘膜清除能力受损有关。吻合口曲霉感染会导致一系列的并发症,包括吻合口裂开,气道狭窄、支气管软化,支气管-肺动脉瘘的形成 [3]。吻合口感染后并发症的发生率远大于未感染的患者,其中支气管肺动脉瘘会导致致命性的大出血 [4]。
TBA 的临床表现通常无特异性,有的患者可无症状,有的可表现为咳嗽、呼吸困难、咯血等,免疫抑制的情况下患者通常很少发热。有研究认为侵袭性 TBA 患者血中 GM 的水平通常不升高,而 BALF 的 GM 水平则升高较明显,且气管镜检查可发现气道内的伪膜,溃疡、红斑及黑痂,所以定期的气管镜检查认为对早期发现 TBA 是有意义的 [1]。
对于肺移植受者发生的 TBA,推荐全身性应用具有抗霉菌活性的三唑类抗真菌药物(包括定植状态的 TBA)或者静脉应用两性霉素脂质体,也推荐将免疫抑制程度降低到最低限度和气管镜下气道内坏死物的清除。另外,对于 TBA 合并支气管吻合口缺血或缺血再灌注损伤者,由吻合口处的血供减少,静脉用药难以在病灶处达到有效的浓度,故推荐两性霉素 B 雾化吸入作为辅助治疗。抗真菌治疗至少 3 个月,或直到 TBA 痊愈。
对于合并吻合口瘘的病人,可能需要气道内支架的植入及手术修复。目前对于支气管瘘的病例研究较少,一般认为这种情况下即使给予系统性的抗真菌治疗,病变仍会进展。尽管 TBA 进展可累及到肺,但是其总的预后要好于侵袭性肺曲霉病,这可能和肺移植术后的常规气管镜检查有助于早期发现 TBA 有关 [2]。
该患者基础病为 IPF,曾应用激素及免疫抑制剂治疗,肺移植术后应用大量抗排异药物,为曲霉感染的高危人群。血 GM 实验正常,BALF GM 试验明显升高,BALF 培养烟曲霉阳性,气管镜下可见吻合口周围坏死物附着,后向气道下层侵袭出现吻合口瘘及胸腔大出血,胸部 CT 肺实质未见曲霉感染影像,可见右主支气管吻合口瘘,与纵隔交通,诊断为侵袭性气管支气管曲霉病、支气管吻合口瘘。治疗上给予加强营养,调整免疫抑制剂应用,静脉应用伏立康唑、卡泊芬净、雾化两性霉素 B,患者病情平稳康复出院。
治疗体会:(1) 术前大量激素及免疫抑制剂的的应用可能是 TBA 的诱因;(2) 及时的支气管镜检查可早期发现吻合口病变和 TBA;(3) 加强营养、康复等支持治疗很重要;(4) 如出现气道-纵隔-胸膜瘘,需保证充分引流,利于感染控制;(5) 由感染造成的吻合口瘘应将免疫抑制下调到不发生排斥的最低程度。
参考文献
1. Krenke R, Grabczak EM. Tracheobronchial Manifestations of Aspergillus Infections. Scientific World Journal. 2011;11:2310-29.
2. Thomas F. Patterson, George R. Thompson III, et al. Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2016 Aug 15; 63(4): e1–e60.
3. 刘青,李培,等. 肺移植术后的气管支气管曲霉病 [J]. 中国感染与化疗杂志;2012,12(3):226-229.
4. NunIey DR, Gal AA. et al. Saprophytic fungal infections and complications involving the bronchial anastomosis following human lung transplantation[J]. chest, 2002,122(4):1185-1191.
